【适应症】
本品是一种甲状旁腺激素类似物(PTH (1-34)),适用于治疗成人甲状旁腺功能减退症。
使用限制:
-未针对术后急性甲状旁腺功能减退症进行临床研究。
-本品的滴定方案仅在通过钙和活性维生素D治疗已实现白蛋白校正血清钙至少为7.8mg/dL的成人中进行了评估。
【推荐剂量】
-推荐起始剂量:
18 mcg,每日1次,皮下注射,可按 3mcg递增或递减进行滴定,目标是在无需使用活性维生素 D(如骨化三醇)或治疗剂量钙(元素钙 > 600mcg / 天)的情况下,将血清钙维持在正常范围内。本品剂量递增间隔不应少于 7 天,递减间隔不应少于 3 天。
-推荐的剂量范围:
6-30mcg,每日1次。
-最大推荐剂量:
30mcg,皮下注射,每日1次。若30mcg的最大剂量仍未达到满意疗效,可考虑添加或重新开始钙和 / 或活性维生素 D 治疗,和 / 或寻求其他治疗方案。
-应根据患者的血清钙水平个体化调整本品剂量。
【剂量调整】
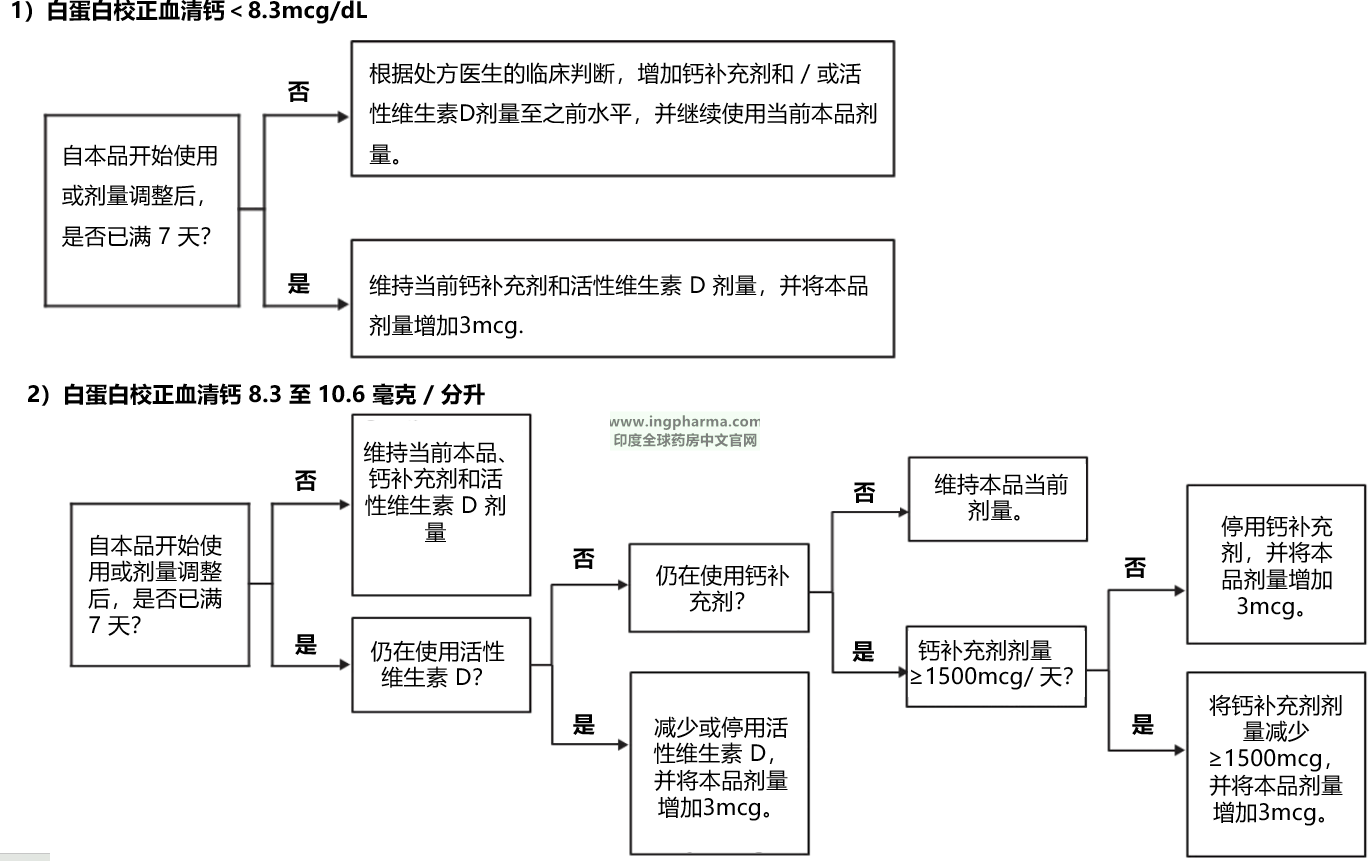
1、白蛋白校正血清钙 <12mcg/dL的滴定建议:
图 1 列出了针对白蛋白校正血清钙≤12 毫克 / 分升的特定范围的成人,本品、活性维生素 D 和钙补充剂的剂量滴定建议。本品的最大推荐剂量为每日30mcg。
图 1:YORVIPATH、活性维生素 D 与钙补充剂的滴定方案
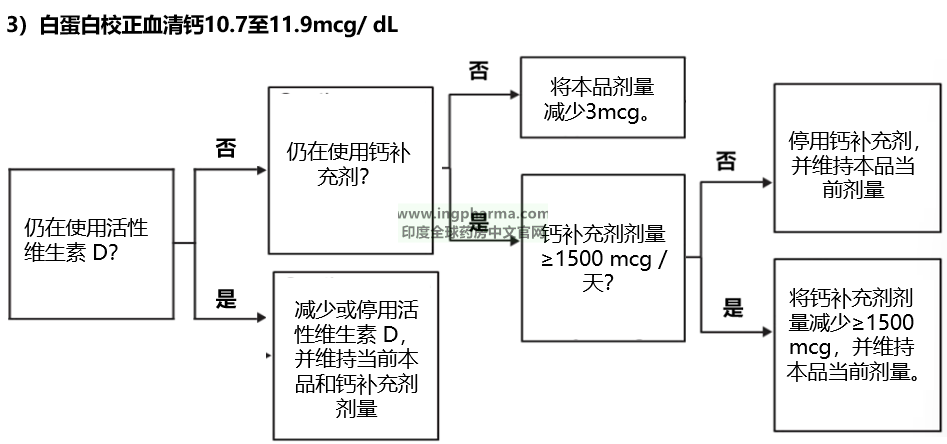
2、白蛋白校正血清钙≥12mcg /dL的滴定建议:
暂停使用本品2 至 3 天,然后重新检测血清钙。若白蛋白校正血清钙仍≥12mcg / dL,需再暂停使用 2 至 3 天,之后再次检测血清钙。一旦白蛋白校正血清钙 < 12mcg / dL,根据图 1 的相应部分,使用最新的血清钙值恢复本品、活性维生素 D 和钙补充剂的滴定。
【服用过量处理】
意外过量使用本品可能导致严重高钙血症,需要医疗干预。研究 1 中有 1 例受试者意外接受了本品处方剂量的约3 倍剂量,连续使用超过 7 天,白蛋白校正血清钙最高升至 16.1 毫克 / 分升,需要住院治疗。
【漏服处理】
若漏服剂量不超过 12 小时,应尽快补服。若漏服时间超过 12 小时,应跳过该次剂量,按计划服用下次剂量。
若本品治疗延迟或中断 3 天或以上,应评估患者的低钙血症体征和症状,并考虑检测血清钙水平。必要时,可恢复或增加钙补充剂和活性维生素 D 的剂量。中断后应尽快按之前的处方剂量恢复使用本品,然后在 7 至 10 天内检测血清钙,并根据图 1 调整 本品、活性维生素 D 和 / 或钙补充剂的剂量。
【不良反应】
常见不良反应(发生率≥5% )包括:注射部位反应、血管舒张相关体征和症状、头痛、腹泻、背痛、高钙血症以及口咽疼痛。
【使用方法】
-本品仅供皮下注射。
-注射区域为腹部或大腿前侧。每日轮换注射部位。
-给药前,只要溶液和容器允许,应目视检查是否存在颗粒物和变色。本品为澄清、无色溶液。若出现固体颗粒、溶液浑浊或变色,请勿使用。
-由于存在直立性低血压的风险,本品首次给药时患者应处于坐姿或卧姿。
-每日推荐剂量仅需一次注射即可达到,通过两次注射达到每日一次推荐剂量会增加血清钙水平意外变化的风险,包括低钙血症和高钙血症。
-在本品首次剂量后以及本品、活性维生素 D 或钙补充剂剂量调整后 7 至 10 天内,应检测患者血清钙水平,并监测低钙血症或高钙血症的临床体征和症状。达到本品维持剂量后,至少每 4 至 6 周检测一次血清钙水平,或在出现低钙血症或高钙血症症状时及时检测。
【注意事项】
-与每日注射次数相关的血清钙水平意外变化:
本品每日仅需注射一次。通过两次注射达到每日一次推荐剂量会增加总给药剂量的变异性。
-严重高钙血症和低钙血症:
本品治疗中曾出现过严重高钙血症和低钙血症。应定期检测血清钙水平,并监测高钙血症和低钙血症的体征和症状。
-骨肉瘤潜在风险:
不建议有骨肉瘤高风险的患者使用本品。
-直立性低血压:
本品治疗中曾报告过直立性低血压。应监测直立性低血压的体征和症状。
-地高辛毒性:
若发生高钙血症,YORVIPATH 与地高辛合用时可能增加洋地黄类药物中毒的风险。合用时,应频繁检测血清钙和地高辛水平,并监测地高辛毒性的体征和症状。
【禁忌】
对本品或本品的任何成分存在严重过敏者,禁用本品。
【特殊人群】
-妊娠:
本品药物研发临床试验中关于妊娠期的数据有限,不足以确定药物相关的重大出生缺陷、流产或其他不良母婴结局风险
-哺乳期:
应监测母乳喂养婴儿的高钙血症或低钙血症症状。可考虑检测母乳喂养婴儿的血清钙水平。
-儿科用药:
本品在儿科患者中的安全性和有效性尚未确立。
-老年人:
在研究 1 中,61 例接受本品治疗的受试者中有 8 例(13%)年龄≥65 岁,而安慰剂组 21 例受试者中有 2 例(10%)年龄≥65 岁。本品的临床试验未纳入足够数量的 65 岁及以上受试者,无法确定其与年轻成人受试者的反应是否存在差异。
-肾功能不全:
轻度、中度或重度肾功能不全患者(估算肾小球滤过率≥15 毫升 / 分钟 / 1.73 平方米)无需调整剂量。
重度肾功能不全患者(估算肾小球滤过率 15-30 毫升 / 分钟 / 1.73 平方米)接受 本品治疗后,总 PTH 水平与肾功能正常受试者相比无临床显著差异。
【药物相互作用】
-已知影响钙代谢的药物:
与本品合用时,应更频繁地检测血清钙水平。
【药理作用】
在生理条件下,帕罗培特利肽释放 PTH (1-34),以维持持续的全身暴露。内源性 PTH 通过增加血清钙水平、降低血清磷水平,维持细胞外钙和磷的稳态。这些作用通过以下方式介导:刺激骨转换以动员骨骼中的钙和磷、促进肾脏钙重吸收和磷排泄、促进活性维生素 D 合成,进而增加肠道对钙和磷的吸收。与内源性 PTH 类似,帕罗培特利肽释放的 PTH (1-34) 通过其主要受体 —— 甲状旁腺激素 1 型受体(PTH1R)发挥作用,该受体在成骨细胞、骨细胞、肾小管细胞和其他多种组织中高度表达。
【贮藏】
本品首次使用前需冷藏于 2℃至 8℃。
- 产品名称:Yorvipath
- 通用名称:palopegteriparatide
- 剂型:注射液
- 规格:168ug/0.56ml*2支 ;294ug/0.98ml*2支 ;420ug/1.4ml*2支
- 生产厂家:Ascendis Pharma Bone Diseases A/S
请按药品说明书或在药师指导下购买和使用

 下载app
下载app