【适应症】
本品是一种针对SLAMF7免疫刺激抗体,适用于:
-与来那度胺(enalidomide)和地塞米松联合治疗先前接受过1-3次治疗的多发性骨髓瘤成人患者。
-与泊马度胺(pomalidomide)和地塞米松联合治疗至少接受过两种治疗(包括来那度胺和蛋白酶体抑制剂)的多发性骨髓瘤成人患者。
【推荐剂量】
-与来那度胺和地塞米松联用:前两个周期每周静脉注射10mg/kg,之后每2周静脉注射一次,直到疾病进展或出现不可接受的毒性。
-泊马度胺(pomalidomide)和地塞米松:前两个周期每周静脉注射10mg/kg,之后每4周静脉注射20mg/kg,直到疾病进展或出现不可接受的毒性。
-治疗前使用地塞米松、苯海拉明、雷尼替丁和对乙酰氨基酚。
【不良反应】
最常见的不良反应(20%或以最常见的不良反应(20%或以上)
•与来那度胺(enalidomide)和地塞米松联用有疲劳、腹泻、发热、便秘、咳嗽、周围神经病变、鼻咽炎、上呼吸道感染、食欲下降、肺炎。
•与泊马度胺(pomalidomide)和地塞米松联用有便秘和高血糖。
【使用方法】
A: EMPLICITI与来那度胺和地塞米松合用时的推荐剂量
EMPLICITI的推荐剂量为前两个周期(28天周期)每周静脉给药10mg/kg,此后每2周静脉给药一次,同时来那度胺和低剂量地塞米松推荐剂量如下所述。继续治疗,直到疾病进展或出现不可接受的毒性。
每次给药前都要给予治疗前用药。
使用地塞米松如下:
•给药当天,在给药前3至24小时口服地塞米松28mg,加上在给药前45至90分钟内静脉注射8mg。
•在未给予EMPLICITI但计划给予地塞米松剂量的天数(第3周期的第8天和第22天以及所有后续周期),口服40mg。
推荐剂量如表1所示:
表1: EMPLICITI联合来那度胺和地塞米松的推荐给药方案
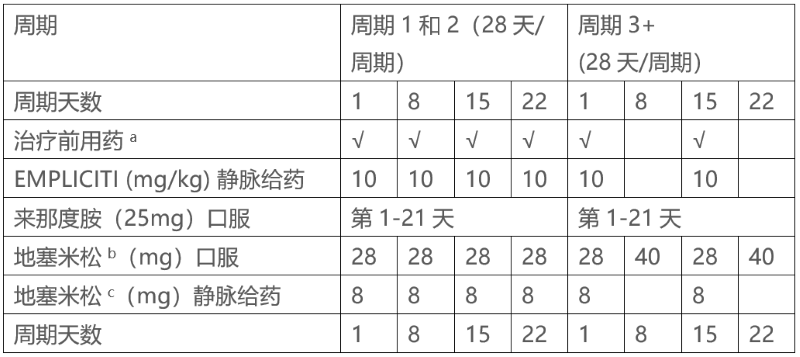
a注射前45至90分钟内使用以下药物:静脉注射8mg地塞米松,H1受体阻滞剂:苯海拉明(25至50mg口服或静脉注射)或等效物;H2受体阻滞剂:雷尼替丁(50mg静脉注射)或等效物;对乙酰氨基酚(650至1000mg口服)。
b在开始EMPLICITI输液3至24小时前口服地塞米松(28mg)。
c在开始EMPLICITI输液 45-90分钟前静脉注射地塞米松。
B: EMPLICITI与泊马度胺(pomalidomide)和地塞米松合用时的推荐剂量
在前两个周期(28天/周期)中,EMPLICITI的推荐剂量为每周静脉注射10 mg/kg。从第3周期(28天/周期)开始,每4周静脉注射EMPLICITI 20 mg/kg。如下文所述(表2),将EMPLICITI与泊马度胺(pomalidomide)和低剂量地塞米松合用。继续治疗直到疾病进展或出现不可接受的毒性。
每次给药前都要给予治疗前用药。
使用地塞米松如下:
• 在使用EMPLICITI的日子里,对于75岁或以下的患者,在使用EMPLICITI前3至24小时内口服地塞米松28mg,并在使用EMPLICITI前45至90分钟内静脉注射8mg;对于75岁以上的患者,在使用EMPLICITI前3至24小时内口服地塞米松8mg,并在使用EMPLICITI前45至90分钟内静脉注射8mg地塞米松。
• 在未给予EMPLICITI但计划给予地塞米松剂量的日子(第3周期的第8、15和22天以及所有后续周期),对75岁或以下的患者口服40mg,对75岁以上的患者口服20mg。
推荐剂量见表2。
表2:EMPLICITI联合泊马度胺(pomalidomide)和地塞米松的推荐给药方案
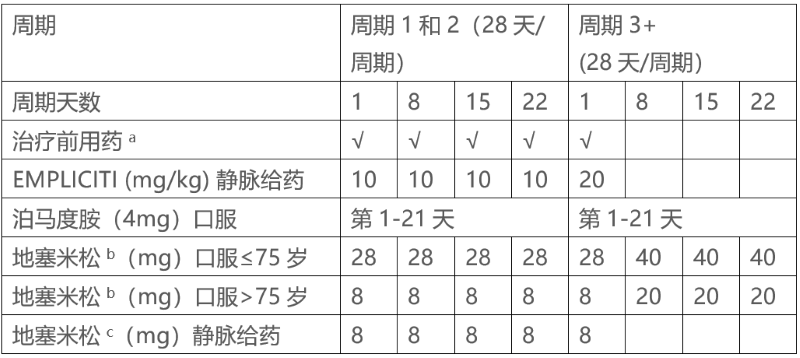
a注射前45至90分钟内使用以下药物:静脉注射8mg地塞米松,H1受体阻滞剂:苯海拉明(25至50mg口服或静脉注射)或等效物;H2受体阻滞剂:雷尼替丁(50mg静脉注射)或等效物;对乙酰氨基酚(650至1000mg口服)。
b在开始EMPLICITI输液3至24小时前口服地塞米松(28mg)。
c在开始EMPLICITI输液 45-90分钟前静脉注射地塞米松。
C:治疗前用药
地塞米松
当EMPLICITI与来那度胺或泊马度胺(pomalidomide)和地塞米松合用时,地塞米松分为口服和静脉给药,如表1和表2所示。
其他药物
除地塞米松外,在输注EMPLICITI前45至90分钟内完成下列药物的给药:
• H1阻滞剂:苯海拉明(口服或静脉注射25至50mg)或等效的H1阻滞剂。
• H2阻滞剂:雷尼替丁(静脉注射50mg或口服150mg)或等效H2阻滞剂。
• 对乙酰氨基酚(650至1000mg口服)。
D:给药
使用自动输液泵,通过输液器和无菌、非致热、低蛋白结合过滤器(孔径为0.2至1.2微米)输注EMPLICITI。
以每分钟0.5ml的速度开始EMPLICITI输注,剂量为10mg/kg。如果没有出现输液反应,则可按表3所述逐步增加输液速度。最大输液速度不应超过5ml每分钟。
表3:10mg/kg EMPLICITI注射速度
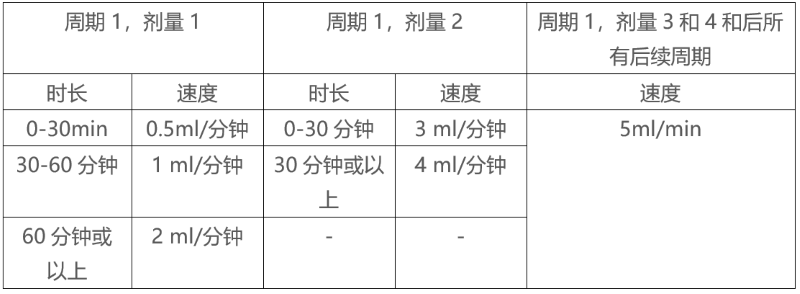
剂量为20mg/kg EMPLICITI起始输注速度为每分钟3ml,。如果没有出现输液反应,则可按表4所述逐步增加输液速度。最大输液速度不应超过5ml每分钟。
在10 mg/kg剂量下上升到5 mL/min的患者,在20 mg/kg剂量下第一次输注时必须将速度降低到3 mL/min。
表4:20mg/kg EMPLICITI注射速度
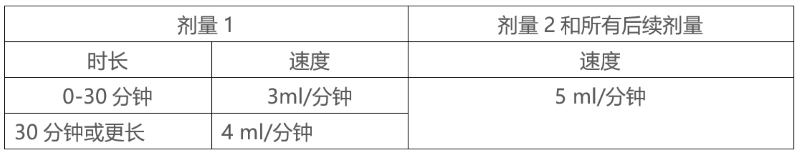
2级或以上输液反应后调整输液速度。
不要将EMPLICITI与其他药品混合使用,也不要将EMPLICITI输液时与其他药物通过同一输液管路输注。尚未进行物理或生化相容性研究来评估EMPLICITI与其他药物的合用。
E: 重新配置和备药
计算剂量
•计算剂量(mg),并根据患者体重确定10 mg/kg和20 mg/kg剂量所需的药瓶数量。
•确定重组所需的无菌注射用水(SWFI)体积,如表5所示。
表5:重新配制EMPLICITI说明
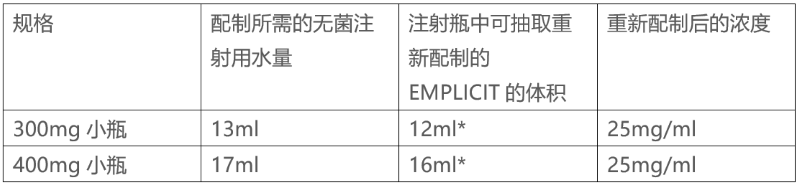
*重新配制后,每个小瓶都含有过量的液体,以便分别提取12ml(300mg)和16ml(400mg)。
重新配制
•用适当尺寸的注射器和小于或等于18号的针头(如17规格)对每个EMPLICITI小瓶进行无菌重新配制。在注射用无菌水USP的过程中可能会遇到轻微的背压,这被认为是正常的。
•保持小瓶直立,旋转小瓶旋转溶液,溶解冻干粉块。将小瓶倒置几次,以溶解小瓶或塞子顶部可能存在的任何粉末。避免剧烈的晃动。不要摇晃。冻干粉应在10分钟内溶解。
•在剩余固体完全溶解后,让重新配置的溶液静置5至10分钟。重组制剂产生无色至微黄色、透明至微乳白色溶液。只要溶液和容器允许,注射前应目视检查注射用药品是否有颗粒物和变色。如果观察到任何颗粒物或变色,则丢弃溶液。
稀释
•完成重新配制后,从每个小瓶中提取计算剂量所需的体积,从400 mg小瓶中最多提取16 mL,从300 mg小瓶中最多提取12 mL
•用0.9%氯化钠注射液或5%葡萄糖注射液进一步稀释到由聚氯乙烯或聚烯烃制成的输液袋中。最终输注浓度应在1 mg/mL和6 mg/mL之间。
•应调整0.9%氯化钠注射液或5%葡萄糖注射液的体积,以使在任何给定剂量的EMPLICITI下不超过患者体重的5mL/kg。
在EMPLICITI冻干粉重组后24小时内完成EMPLICITI输液。如果不立即使用,输液可在冷藏条件下储存:2°C至8°C(36°F-46°F),并避光最多24小时(24小时中最多8小时可储存在室温、20°C至25°C室内光线下)。
【注意事项】
• 输液反应:需要治疗前用药。2级或以上中本品I,严重输液反应永久停药。
• 感染:监测发烧和其他感染迹象,并及时治疗。
• 第二原发性恶性肿瘤(SPM):在多发性骨髓瘤患者接受本品治疗的对照临床试验中观察到SPM发生率较高。
• 肝毒性:监测肝功能,如果怀疑有肝毒性,停止使用。
• 干扰测定完全应答:本品可干扰用于监测M蛋白的分析。这种干扰会影响完全响应的确定。
【药理作用】
Elotuzumab是一种特别针对SLAMF7 (传讯淋巴细胞活化分子家族成员7)蛋白的人源化IgG1单株抗体。SLAMF7会表现于骨髓瘤细胞上,此表现与细胞遗传变异无关。SLAMF7也会表现于天然杀手细胞、血浆细胞上,并有少量表现于造血细胞谱系中之已分化细胞的特定免疫细胞子群上。
Elotuzumab会透过SLAMF7路径直接活化天然杀手细胞。Elotuzumab也会针对骨髓瘤细胞上的SLAMF7产生作用,并与作用细胞上的Fc接受体交互作用,透过抗体依赖性细胞毒性作用(ADCC)及抗体依赖性细胞吞噬作用(ADCP)而杀死骨髓瘤细胞。非临床模型显示,elotuzumab与lenalidomide并用可促进活化天然杀手细胞的作用,其效果要大于单独使用个别药物。而临床前的体外与活体试验皆证实,elotuzumab与lenalidomide并用可提高抗肿瘤疗效活性。Elotuzumab与pomalidomide并用也于活体试验证实可提高抗肿瘤疗效活性。
【贮藏】
在2°C至8°C(36°F-46°F)的温度下冷藏。在使用前,将其存放在原包装中,以防阳光照射。不要冷冻或摇晃。
- 产品名称:Empliciti
- 通用名称:Elotuzumab
- 剂型:注射液
- 规格:300mg
- 生产厂家:BRISTOL MYERS SQUIBB
请按药品说明书或在药师指导下购买和使用

 下载app
下载app